Dans cet article, le psychologue et expert international en Alzheimer et autres démences, Cristian Francisco Liébanas Vega, nous parle de la prématurité et de la rééducation neuropsychologique chez les prématurés.
La prématurité constitue un problème sérieux à la fois pour le nouveau-né et sa famille, car elle est associée à une morbidité élevée à la naissance et à un risque élevé de handicaps futurs. Le nombre d’enfants nés prématurément et leur survie ont considérablement augmenté au cours des dernières décennies grâce aux progrès des soins obstétricaux et néonatals. La réduction de leur mortalité sans augmentation de la morbidité et des séquelles constitue l’un des défis les plus importants de la médecine périnatale (Rodrigo et al., 2014).
On parle de naissance prématurée ou préterme lorsque l’accouchement a lieu avant 37 semaines de gestation.
La prématurité peut être classée en différents groupes en fonction de l’âge gestationnel auquel survient cette naissance, ou en fonction du poids du nouveau-né, car généralement ces deux paramètres sont liés chez ces enfants. Plus l’âge gestationnel est faible et plus le poids à la naissance est faible, plus la probabilité de présenter des complications liées à la prématurité est élevée, plus le risque de décès et de séquelles dans le neurodéveloppement est élevé.
Il existe certaines variables pour classer la prématurité, telles que l’âge gestationnel ou le poids à la naissance. Selon l’âge gestationnel, les nouveau-nés prématurés sont classés comme suit :
- Prématurité tardive : naissance entre la semaine 34+0 et la semaine 36+6.
- Prématurité modérée : naissance entre la semaine 32+0 et la semaine 33+6.
- Très prématurité : naissance entre la semaine 28+0 et la semaine 31+6.
- Extrême prématurité : naissance avant la semaine 28.
Selon le poids à la naissance, les nouveau-nés prématurés sont classés comme suit :
- Poids faible à la naissance : poids inférieur à 2500 grammes.
- Très faible poids à la naissance : poids entre 1000 et 1500 grammes.
- Poids extrêmement faible à la naissance : poids entre 800 et 1000 grammes.
- Poids très extrêmement faible à la naissance : poids inférieur à 800 grammes.
Il est également important de souligner le concept de poids par rapport à l’âge gestationnel. Un nouveau-né de faible poids pour l’âge gestationnel est celui qui a un poids de naissance inférieur au P10 pour l’âge gestationnel et le sexe. Cela signifie qu’un nouveau-né peut être prématuré (< 37 semaines), à terme (37 à 41 semaines 6 jours) ou post-terme (> 42 semaines) et avoir un poids faible (< P10), un poids approprié (PIO-P90) ou un poids élevé (> P90) pour son âge gestationnel.
Les nouveau-nés pesant 1500 grammes ou moins, ayant un âge gestationnel de 32 semaines ou moins et un poids faible pour l’âge gestationnel, sont considérés comme des nouveau-nés à risque neuropsychosensoriel, avec une probabilité accrue de séquelles dans leur neurodéveloppement et nécessiteront un suivi neuro-maturatif jusqu’à au moins 6 ans, dans le domaine de l’intervention précoce (Federación Estatal de Asociaciones de Profesionales de Atención Temprana, 2005) ainsi qu’un suivi ultérieur des fonctions exécutives, du rythme d’apprentissage scolaire, de la coordination motrice, des compétences d’adaptation et du comportement, au moins pendant la deuxième enfance et l’adolescence.
Épidémiologie et étiopathogenèse
Selon l’Organisation mondiale de la santé (OMS) (Liu et al., 2016), chaque année, environ 15 millions d’enfants prématurés naissent dans le monde, avec un taux de prématurité variant entre 5 % et 18 %, et se situant en Espagne et dans les pays voisins autour de 7 % et 9 % de toutes les naissances. Environ 10 % de ce groupe correspondent à des nouveau-nés prématurés de moins de 32 semaines et moins de 1500 grammes, qui concentrent la plus grande incidence de mortalité, de morbidité et de séquelles tout au long de leur développement (Ponte et al., 2022). Le groupe des prématurés tardifs (34 semaines à 36+6) est le plus nombreux (70-74 % du total des nouveau-nés prématurés) et bien qu’un pourcentage élevé n’ait pas besoin d’hospitalisation, ils présentent néanmoins un risque de complications et de séquelles pendant leur développement plus élevé que celui d’un nouveau-né à terme (Liu et al., 2016).
Dans l’étiopathogenèse de l’accouchement prématuré, de nombreux facteurs interviennent (Rellán et al., 2008) :
- facteurs dépendants de la mère : facteurs reproductifs, maladies, habitudes toxiques, facteurs gynécologiques, stress, antécédents de prématurité, etc.,
- facteurs fœtaux (anomalies congénitales, retard de croissance intra-utérin, infections, perturbation du bien-être fœtal, etc.),
- grossesse multiple,
- complications propres à la grossesse : prééclampsie, rupture prématurée des membranes, etc.
Cependant, dans 70 % des cas, l’accouchement prématuré se produit de manière spontanée, ce qui rend sa prévention primaire difficile, soit en raison d’un début prématuré du travail (45 %), soit d’une rupture prématurée des membranes (25 %). Les 30 % restants correspondent à des cas où l’accouchement est programmé par un médecin en raison de problèmes maternels ou fœtaux (Rellán et al., 2008). Il est important de mentionner l’augmentation générale des taux de prématurité au cours des 10 à 20 dernières années.
Cette augmentation peut être attribuée dans notre milieu à de nombreux facteurs qui se produisent simultanément, tels que les progrès des soins périnataux, l’amélioration des méthodes d’évaluation, l’augmentation de l’âge des femmes enceintes et donc de la prévalence de maladies telles que le diabète sucré ou l’hypertension artérielle, une demande accrue et une utilisation accrue des techniques de procréation assistée (non seulement la grossesse multiple augmente le risque, mais il augmente également si la grossesse est unique). Dans cette augmentation du taux de prématurité, le nombre croissant de prématurés tardifs a influencé, maintenant inchangé le pourcentage de naissances à un âge gestationnel égal ou inférieur à 32 semaines (Rellán et al., 2008).
En résumé, la population de nouveau-nés prématurés est très hétérogène en ce qui concerne son étiologie, sa clinique, ses complications et son pronostic, ce qui nécessite une approche multidisciplinaire.
S’abonner à notre Newsletter
Lésion cérébrale chez le nouveau-né prématuré à terme
Selon le Dr. Miranda (2006), la naissance prématurée en soi, ainsi que tous les stimuli auxquels le cerveau est exposé dans l’environnement extra-utérin, affectent dans une certaine mesure le développement cérébral normal du nouveau-né prématuré à terme, qui dépendra du développement cérébral intra-utérin, de l’âge et de la cause de la prématurité, de la pathologie périnatale (épisodes d’hypoxie, d’hypotension, d’hypercapnie, d’infections…), du traitement intensif nécessaire pendant les premières semaines de vie et du type, de la localisation et de l’ampleur des lésions cérébrales possibles. Le cerveau d’un nouveau-né prématuré à terme extrême, à 40 semaines, a une moindre complexité de ses sillons et circonvolutions, un volume plus faible et une maturation moindre de la substance blanche par rapport à celui d’un nouveau-né à terme (Miranda, 2006).
Les complications neurologiques/neuropsychologiques sont fréquentes chez le nouveau-né prématuré à terme, et il est habituel que plusieurs facteurs se présentent simultanément ou successivement pour générer plus d’un type de lésion (Cerisola et al. 2019).
Chez le nouveau-né prématuré à terme, la pathologie du SC est le plus fréquemment associée aux hémorragies intracrâniennes (HIC), aux lésions de la substance blanche ($B) et aux lésions du cervelet.
Hémorragie intracrânienne (HIC)
Les HIC qui se produisent chez le nouveau-né prématuré à terme comprennent l’hémorragie du germe de la matrice (HGM), l’hémorragie intraventriculaire (HIV) et les hémorragies parenchymateuses, ces dernières étant moins fréquentes. Tant l’HGM que l’HIV peuvent être regroupées sous le terme d’hémorragie peri-intraventriculaire (HPIV) et constituent la principale complication pouvant entraîner une lésion cérébrale chez le nouveau-né prématuré à terme.
La source la plus fréquente des hémorragies dans le cerveau du nouveau-né prématuré à terme est le germe de la matrice (GM), une structure située dans la région sous-épendymaire périventriculaire et fortement vascularisée. Lorsqu’il y a une HGM, elle peut rompre l’épendyme sous-jacent et pénétrer dans les ventricules, constituant ainsi l’HIV (Ballabh, 2014).
L’HPIV est classifiée en différents stades définis par la présence ou l’absence d’hémorragie dans les ventricules, le pourcentage d’hémorragie intraventriculaire, et la présence ou l’absence d’infarctus hémorragique périventriculaire.
- Grado I: l’hémorragie est localisée dans la MG subépendymaire,
- Grado II: il y a du sang intraventriculaire qui occupe moins de 50 % de la zone du ventricule sans dilatation ventriculaire,
- Grado III: il y a du sang intraventriculaire qui occupe plus de 50 % de la zone du ventricule avec dilatation ventriculaire.
- Grado IV: hémorragie intraventriculaire et intraparenchymateuse, qui correspond à une infarctus hémorragique veineux périventriculaire.
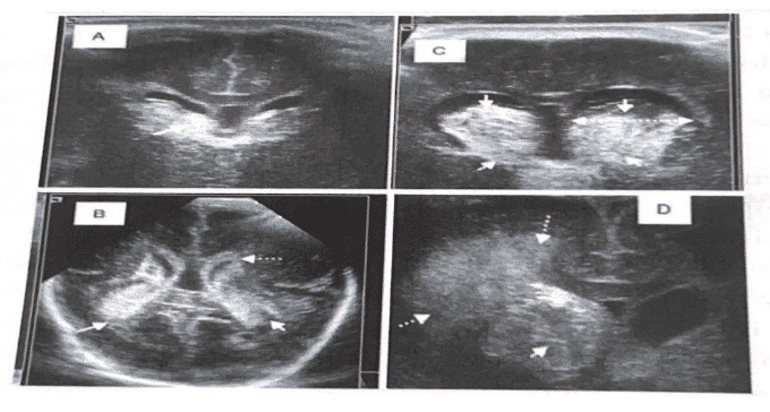
La hémorragie à ce niveau entraînera une perte de ses cellules progénitrices et en raison de la pression provoquée par l’hémorragie et du stress oxydatif qui en découle, la lésion de la SB environnante sera aggravée, contribuant à la leucomalacie périventriculaire (LPV) (Cerisola et al., 2019).
La HIMG se produit chez les PRNP en raison de multiples facteurs. Selon les études menées par Ballabh (2014) sur sa pathogénie, « la fragilité des vaisseaux sanguins prépare le terrain et les fluctuations hémodynamiques, associées à un manque ou une immaturité des mécanismes d’autorégulation, déclenchent l’hémorragie. » Des situations telles que l’accouchement par voie vaginale, un score bas à l’épreuve d’APGAR, une détresse respiratoire grave, un pneumothorax, une hypoxie et une hypercapnie, des convulsions, un canal artériel persistant, des infections… seront d’importants facteurs de risque de fluctuations hémodynamiques. Les altérations plaquettaires et de la coagulation aggraveront cette situation (Ballabh, 2014).
Rééducation neuropsychologique chez les prématurés
Les bébés nés avant 37 semaines sont considérés comme prématurés. Ils sont exposés au risque de problèmes de développement, tant cognitifs que moteurs. Le développement cognitif fait référence aux capacités de pensée et d’apprentissage. D’autre part, le développement moteur fait référence à la capacité de se déplacer, de ramper ou de marcher.
Par conséquent, les enfants prématurés ont plus de chances de développer une pathologie neuropsychologique. Ces pathologies peuvent être plus ou moins graves. Parmi celles-ci, citons les troubles de l’apprentissage, le TDAH, les altérations auditives, visuelles ou du langage, la dyslexie, les TSA ou la paralysie cérébrale.
La rééducation neuropsychologique pédiatrique est destinée aux enfants présentant des troubles neurologiques affectant leur capacité fonctionnelle. L’objectif est de leur permettre d’atteindre leur autonomie maximale et de les aider à développer leurs capacités.
Ainsi, la rééducation neuropsychologique pédiatrique est initiée dès les premiers mois de vie et, dans de nombreux cas, revêt un caractère préventif.
Maintenant, on peut se demander s’il existe des preuves scientifiques des bienfaits de cette intervention précoce.
L’intervention précoce est-elle bénéfique ?
Selon une étude d’Alicia Spittle, Jane Orton et al., les programmes d’intervention précoce pour les bébés prématurés ont une influence positive sur les plans cognitif et moteur pendant l’enfance. De plus, les avantages cognitifs persistent à l’âge préscolaire.
En revanche, aucune preuve d’un effet positif à long terme à l’âge adulte de ces avantages cognitifs ou moteurs n’a été trouvée.
Par conséquent, l’objectif de cette rééducation est de favoriser le développement cognitif en réduisant les chances de problèmes cognitifs et moteurs à court et moyen terme.
Bibliographie
- Abbott, A. (2015). Neuroscience: The brain, interrupted. Nature, 518(7537), 24-26.https://dor.org/10.1038/518024ª
- Abiramalatha, T., Bandyopadhyay, T., Ramaswamy, V. V., Shaik, N. B., Thanigainathan, S., Pullattayil, A. K., & Amboiram, P. (2021). Risk Factors for Periventricular Leukomalacia in Preterm Infants: A Systematic Review, Meta-analysis, and GRADE-Based Assessment of Certainty of Evidence. Pediatric Neurology, 124, 51-71. https://doi.org/10.1016/j.pediatrneurol.2021.08.003
- Ancel, P.-Y., Goffinet, F., EPIPAGE-2 Writing Group, Kuhn, P., Langer, B., Matis, J.. Hernandorena, X., Chabanier, P., Joly-Pedespan, L., Lecomte, B., Vendittelli, F., Dreyfus, M., Guillois, B., Burguet, A., Sagot, P., Sizun, J., Beuchée, A., Rouget, F., Favreau, A., … Kaminski, M. (2015).
- Survival and morbidity of preterm children born at 22 through 34 weeks’ gestation in France in 2011: Results of the EPIPAGE- Conor study. JAMA1693), https://doi.org/10.1001/jamapediatrics.2014.3351
- Anderson, V., Northam, E., & Wrennall, J. (2018). Developmental Neuropsychology: A Clinical Approach. Psychology Press.
- Ballabh, P. (2014). Pathogenesis and prevention of intraventricular hemorrhage. Clinics in Perinatology, 41(1), 47-67. https://doi.org/10.1016/j.clp.2013.09.007
- Baron, I. S. (2018). Neuropsvchological Evaluation of the Child: Domains, Methods, and Case Studies. Oxford University Press.
- Bax, M., Goldstein, M., Rosenbaum, P., Leviton, A., Paneth, N., Dan, B., Jacobsson, B. Damiano, D., & Executive Committee for the Definition of Cerebral Palsy. (2005). Proposed definition and classification of cerebral palsy, April 2005. Developmental Medicine Child Neurology, 478),571-576. https://doi.org/10.1017/s001216220500112x
- Beaino, G., Khoshnood, B., Kaminski, M., Marret, S., Pierrat, V., Vieux, R., mThiriez, G., Matis, J., Picaud, J.-C., Rozé, J.-C., Alberge, C., Larroque, B., Bréart, G., Ancel, P.- Y., & EPIPAGE Study Group. (2011). Predictors of the risk of cognitive deficiency in very preterm infants: The EPIPAGE prospective cohort. Acta Paediatrica (Oslo, Norway: 1992), 100(3), 370-378. https://doi.org/10.1111/j.1651-2227.2010.02064.x
- Beauchamp, M. H., Peterson, R. L., Ris, M. D., ‘Taylor, H. G., & Yeates, K. O. (2022). Pediatric Neuropsychology: Research, Theory, and Practice. Guilford Publications.
- Burstein, O., Zevin, Z., & Geva, R. (2021). Preterm Birth and the Development of Visual Attention During the First 2 Years of Life: A Systematic Review and Meta-analysis. JAMA Network Open 43), e213687.https://doi.org/10.1001/jamanetworkopen.2021.3687
- Cantallops, A. E., & Rovira, T. R. (2015). Neuropsicologia pediátrica. Editorial Sintesis.
- Castro-Caldas, A., Petersson, K. M., Reis, A., Stone-Elander, S., & Ingvar, M. (1998). The illiterate brain. Learning to read and write during childhood influences the functional organization of the adult brain. Brain: A Journal of Neurology, 121 (Pt 6), 1053-1063. https://doi.org/10.1093/brain/121.6.1053
- Cerisola, A., Baltar, F., Ferrán, C., & Turcatti, E. (2019). Mecanismos de lesión cerebral en niños prematuros. Medicina (Buenos Aires), 79, 10-14. Chakraborty, R., Vijay Kumar, M. J., & Clement, J. P. (2021). Critical aspects of neurodevelopment. Neurobiology of Learning and Memory, 180, 107415. https://doi.org/10.1016/j.nlm.2021.107415
- Dennis, M. (1988). Language and the young damaged brain. En Clinical neuropsychology and brain function: Research, measurement, and practice (pp. 89-123). American Psychological Association. https://doi.org/10.1037/10063-003
- Díez-Cirarda, M., Yus, M., Gómez-Ruiz, N., Polidura, C., Gil-Martínez, L., Delgado-Alonso, C., Jorquera, M., Gómez-Pinedo, U., Matias-Guiu, J., Arrazola, J., & Matias-Guiu, J. A. (2022). Multimodal neuroimaging in post- COVID syndrome and Correlation with cognition. Brain, awac384. https://doi.org/10.1093/brain/awac384
- Federación Estatal de Asociaciones de Profesionales de Atención Temprana. (2005). Libro Blanco de la Atención Temprana. Real Patronato sobre Discapacidad.
- Fuentefria, R. do N., Silveira, R. C., & Procianoy, R. S. (2017). Motor development of preterm infants assessed by the Alberta Infant Motor Scale: Systematic review article. Jornal De Pediatría, 934),328-342. https://doi.org/10.1016/j.jped.2017.03.003
- García, P., San Feliciano, L., Benito, F., García, R., Guzmán, J., Salas, S., Fernandez, C., del Prado, N., Ciprián, D., & Figueras, J. (2013). Evolución a los 2 años de edad corregida de una cohorte de recién nacidos con peso inferior o igual a 1.500 g de los hospitales pertenecientes a la red neonatal SEN1500. Anales de Pediatria, 795), 279-287. https://doi.org/10.1016/j.anpedi.2013.03.017
- García Reymundo, M., Hurtado Suazo, J. A., Calvo Aguilar, M. J., Soriano Faura, F. J., Ginovart Galiana, G., Martin Peinador, Y., Jiménez Moya, A., & Demestre Guasch, X. (2019). Recomendaciones de seguimiento del prematuro tardio. Anales de Pediatria, 905), 318.el-318.8. https://doi.org/10.1016/j.anpedi.2019.01.008
- Garrido, A., Alfonso, M., Gómez, M., Niño, G., Patiño, M., & Luque, Y. (2014). Edad motora versus dad corregida en infantes prematuros y con bajo peso al nacer. Revista de Facultad de Medicina, 62, 205-211. https://doi.org/10.15446/revfacmed.v62n2.45376
- GAT. (s. f.). Libro Blanco de la Atención Temprana. Recuperado 6 de noviembre de2022, De https://www.observatonodelainfancia.es/ora/esp/documentos_ficha.aspx?id=807
- GERRARD-MORRIS, A., TAYLOR, H. G., YEATES, K. O., WALZ, N. C., STANCIN, T., MINICH, N., & WADE, S. L. (2010). Cognitive development after traumatic brain injury in young children. Journal of the International Neuropsvchological Society:JINS, 161), 157-168. https://doi.org/10.1017/S1355617709991135
- Gerrard-Morris, A., Taylor, H. G., Yeates, K. O., Walz, N. C., Stancin, T., Minich, N., & Wade, S. L. (2010). Cognitive development after traumatic brain injurv in voung children. Journal of the International Neuropsychological Society: JINS, 16(1), 157-168. https://doi.org/10.1017/S1355617709991135
- Gotardo, J. W., Volkmer, N. de F. V., Stangler, G. P., Dornelles, A. D., Bohrer, B. B. de A., & Carvalho, C. G. (2019). Impact of peri-intraventricular haemorrhage and periventricular leukomalacia in the neurodevelopment of preterms: A svstematic review and meta-analvsis. PloS One, 1410), e0223427. https://doi.org/10.1371/journal.pone.0223427

Laisser un commentaire